Science
先進的な遺伝子治療で遺伝性網膜疾患に挑む
遺伝性網膜変性疾患(IRD)は遺伝子変異により視細胞や網膜色素上皮(RPE)が変性する一連の疾患を指します。特に網膜色素変性は、全世界で約150万人が患っている最も一般的なIRDです。私たちは網膜外層疾患を対象に、希少疾患や難治性疾患への先端医療の開発を進めています。従来の治療手段は症状の進行を抑制するに過ぎないため、私たちはRHO(ロドプシン)遺伝子変異に特化して、ゲノム編集技術とHITI遺伝子挿入を活用した革新的な治療法の開発に注力しています。広島大学と協力して高特異性ZFN(Zinc Finger Nuclease)の効率化に成功し、CRISPR-Cas9と同等の切断効率を実現しています。さらに、神戸アイセンター病院との連携により、精度の高い遺伝子導入手法の確立に向けて積極的な研究を展開しています。
遺伝性網膜変性疾患(IRD)
遺伝子変異が原因で視細胞や網膜色素上皮(PRE)に進行性の変性を示す疾患は遺伝性網膜変性疾患(Inherited Retinal Dystrophy; IRD)と総称されます。IRDのうち最も多い疾患は網膜色素変性(Retinitis Pigmentosa)で世界では約150万人の患者数が推定されており、神戸市立神戸アイセンター病院をはじめとした各医療機関の遺伝子診断より約300の関連遺伝子が報告されています。これらの遺伝子の殆どはRPEや視細胞で重要な機能を担うため、視細胞やRPEに変性が生じ、死滅に至ります。 これまで網膜色素変性に対する根本的な治療法は確立されておらず、症状の進行を遅らせる目的の対症療法が主流となっています。医療機関における現在の治療としては、薬(暗順応改善薬や血流改善薬・ビタミン剤)や、強い光を避けるための遮光メガネなどの補助器具が用いられます。(参考:日本眼科学会HP・難病情報センターHP)
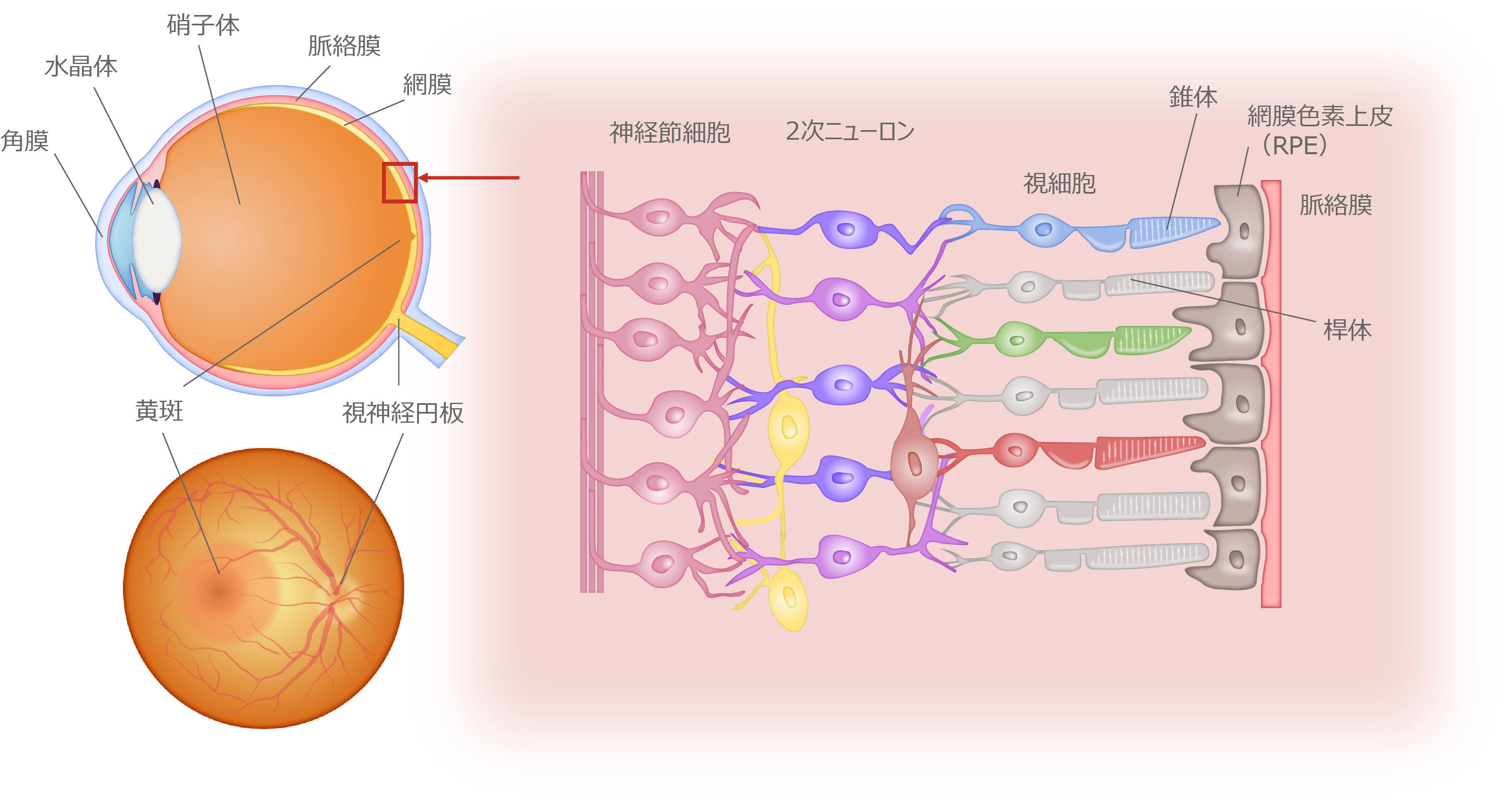
眼球と網膜の構造
網膜色素変性と加齢黄斑変性患者の視覚障害
この図は、網膜色素変性(RP)と加齢黄斑変性(AMD)の患者が経験する異なる視覚障害を示しています。患者は時間とともに視力を徐々に失います。RP患者の場合、最初に周辺視野が失われ、次第に中央に向かって閉じていきます。一方で、AMD患者は最初に中央視野を失い、細部に焦点を合わせるのが困難になります。

原因遺伝子治療とは
近年の科学技術の発展により、従来のような低分子化合物の製剤だけでなく、高分子や核酸・細胞など多様な形態の医薬品が開発・実用化されはじめています。こうした治療薬・治療法の分類をするため、「創薬/医薬モダリティ(様式)」という言葉が用いられています。遺伝子治療は、遺伝子(DNA, RNA等)を用いたり、患者の遺伝子(ゲノム)を標的とする新規の創薬モダリティで、一般的には疾患の原因遺伝子に直接働きかける治療法とされる原因遺伝子治療(Gene-targeted therapeutics)を指すことが多いです。近年では遺伝子診断の技術や受診体制が充実している背景もあり、特に原因遺伝子が特定されている遺伝性疾患においては、従来型のモダリティ(低分子化合物や抗体等)では技術的に難しかった根本的な治療効果が期待されています。私たちは網膜色素変性の中で最も一般的な顕性遺伝型、特にRHO(ロドプシン)遺伝子の変異に焦点を当て、治療法の開発を推進しています。
原因遺伝子治療
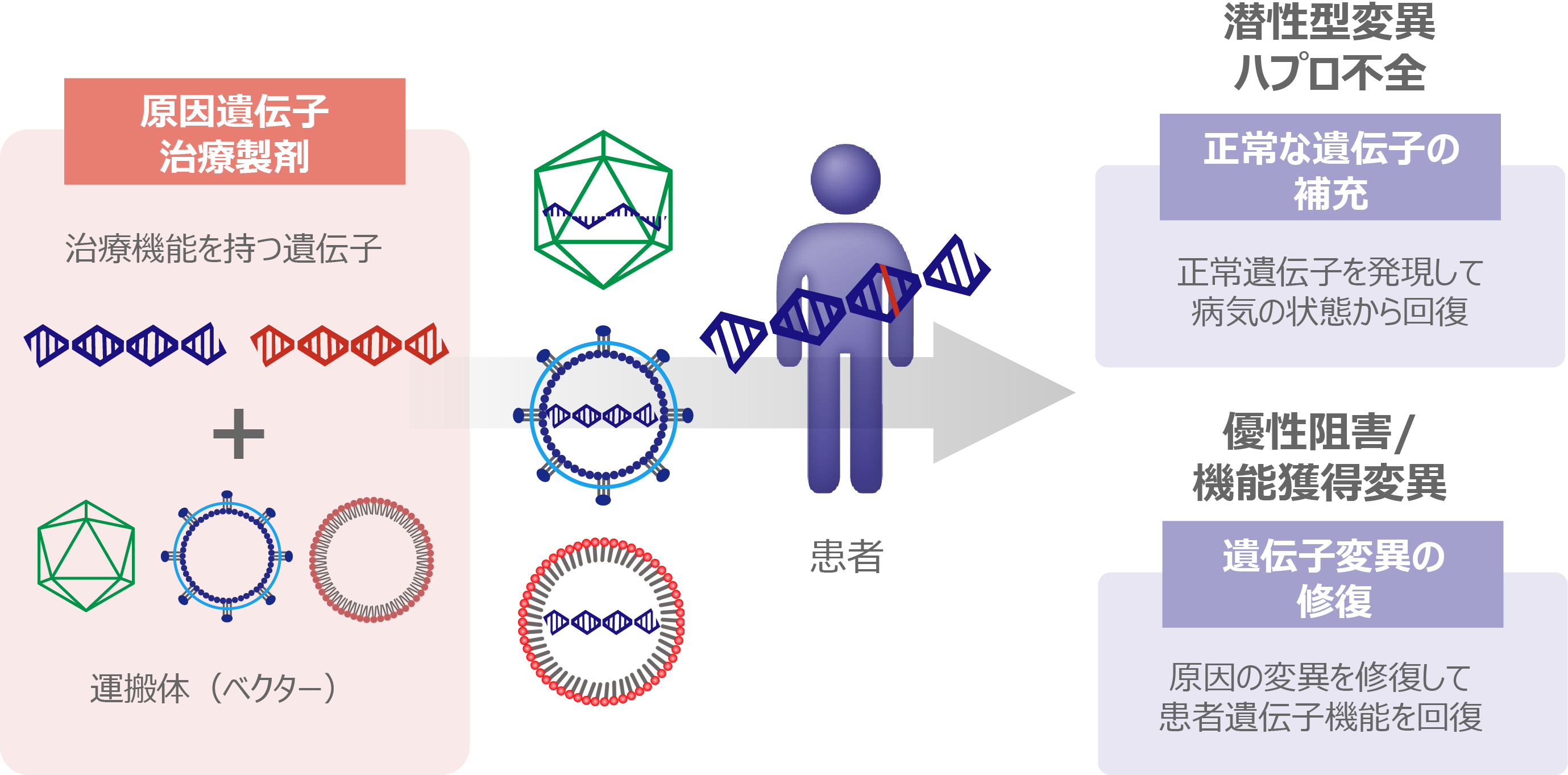
潜性型変異に対する遺伝子治療
原因遺伝子治療にも様々な手法がありますが、IRDにおいては、概ね原因遺伝子変異の遺伝形式(潜性型・顕性型)によって異なる方法が用いられます。潜性型変異は、変異原因遺伝子から作られた遺伝子やタンパク質が機能せず、かつ野生型の遺伝子の働きに影響を与えない遺伝形式で、2本ある対立遺伝子の両方に変異を持っています。この場合の遺伝子治療は、視細胞やRPEには機能する遺伝子が無いため、外部から正常な遺伝子を導入して目的の機能を補完する手法(補充療法)が主流です。
顕性型変異に対する遺伝子治療
顕性型変異は、2本ある対立遺伝子の片方の変異で発症に至る遺伝形式で、ハプロ不全と優性阻害/機能獲得変異の発症原因があります。ハプロ不全とは、残っている1本の遺伝子座から発現される遺伝子産物では量が足りず、本来の機能の維持が困難になる場合を指します。ハプロ不全では、潜性型と同様に正常な遺伝子の補充が必要となります。優性阻害/機能獲得変異とは、変異原因遺伝子から作られた遺伝子やタンパク質が本来とは異なる挙動を示すために、細胞や野生型の遺伝子の働きに変容を及ぼす現象を指します。この場合の遺伝子治療には、遺伝子変異部の修復(ゲノム編集)が必要となります。
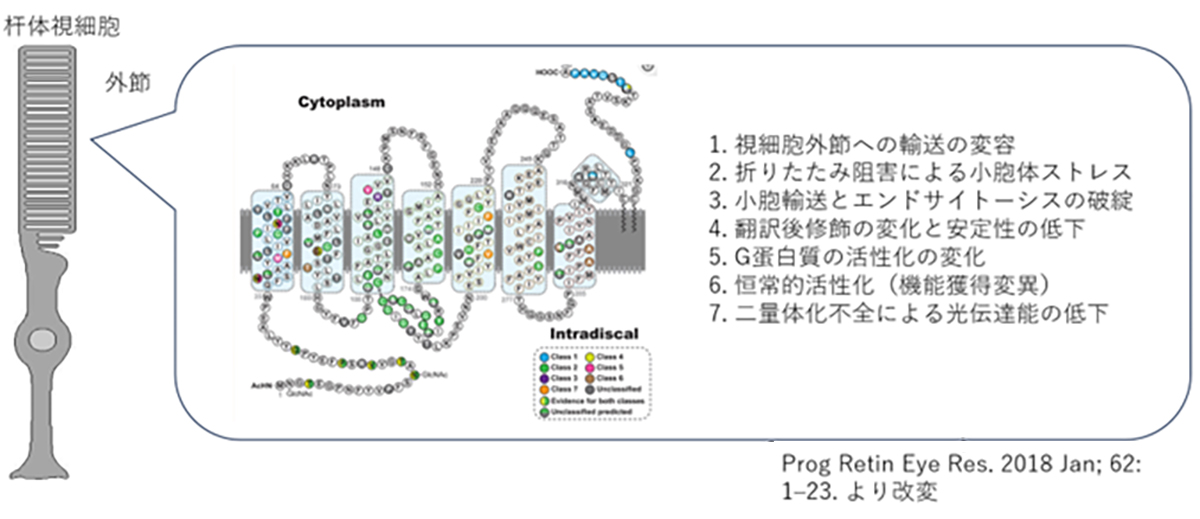
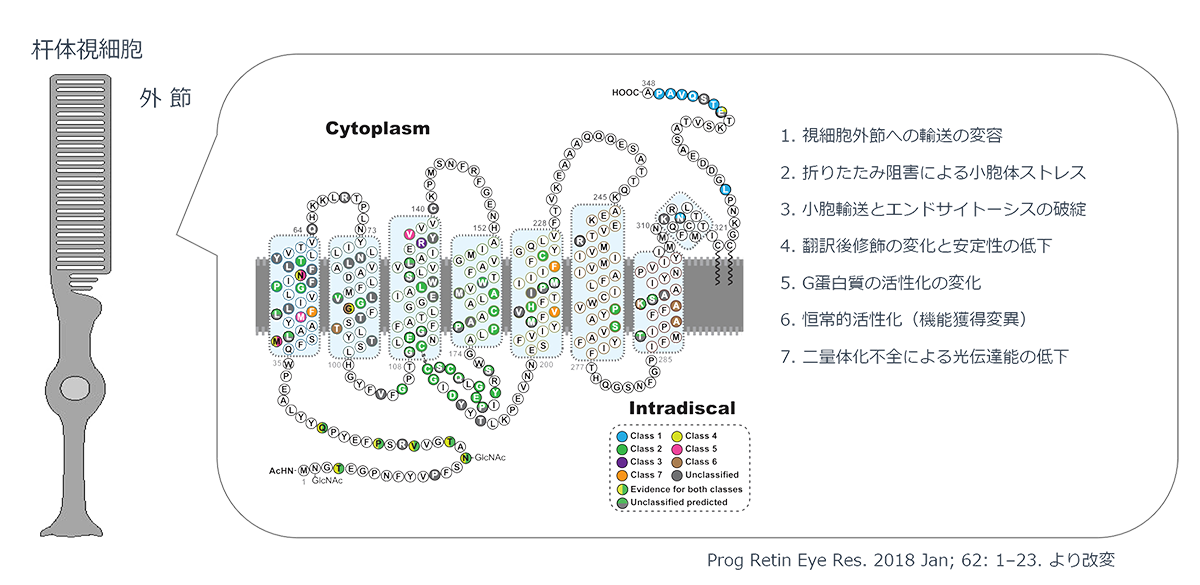
変異ロドプシンによる網膜色素変性の発症機構
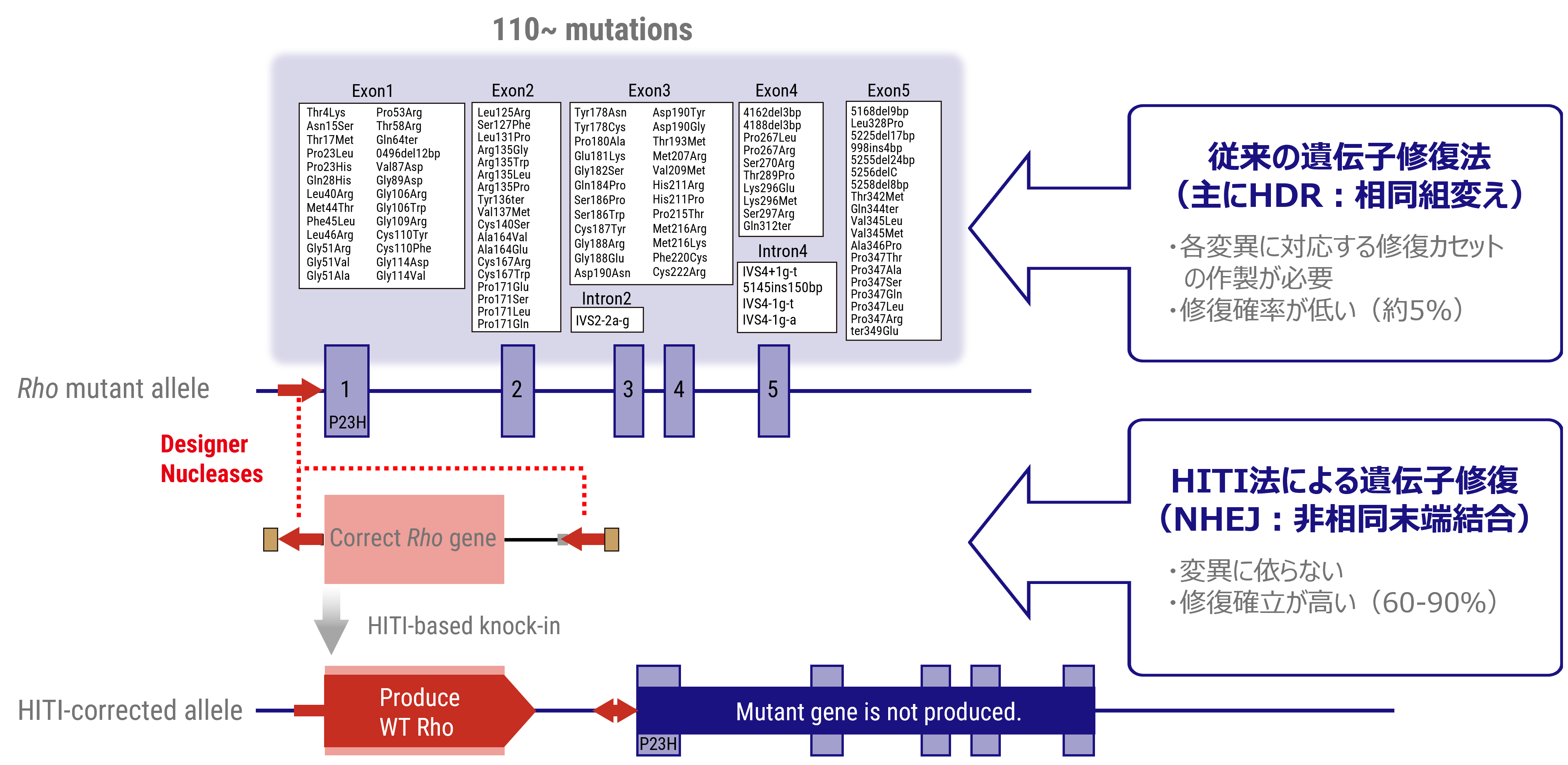
ヒトのロドプシンは348のアミノ酸から構成されていますが、これまでの遺伝子診断より110カ所の異なる変異が報告されています。変異遺伝子のほとんどが優性阻害/機能獲得変異を示しますが、機能変容は変異場所による事が知られており、光感受性の低下や恒常的活性化やロドプシンタンパク質の輸送不全などがあります。また阻害効果も変異により異なるため、低分子化合物などを用いての対症療法には適切な薬剤処方が必要です。加えてロドプシン遺伝子はハプロ不全でも発症する原因遺伝子であるため、RHOを標的とした原因遺伝子治療製剤には優性阻害となる原因変異の修復と、正常RHO遺伝子発現の補充の両方への対処が必要です。
ゲノム編集による治療
顕性遺伝型のうち特に優性阻害により発症する遺伝子変異に対しては、ゲノム編集技術による治療法が高い効果を期待されています。ゲノム編集は細胞の遺伝情報(ゲノム)を書き換える技術の総称であり、ゲノム本体であるDNAや転写産物のmRNAの特定の配列を狙って変化させることが可能となります。 私たちの遺伝子治療開発方針として、ゲノム編集による治療に重点を置いています。広島大学との共同研究を通じて、高い特異性を持つZFN(Zinc Finger Nucleases)の効率的な設計方法を開発し、成体視細胞でCRISPR-Cas9と同等の切断効率を達成しました。さらに、HITI遺伝子挿入を用いた治療製剤開発にも注力しています。加えて、神戸アイセンター病院との連携により、適切な遺伝子導入手法の確立に向けた研究を進めています。
ゲノム編集による治療方法(変異の修復方法)
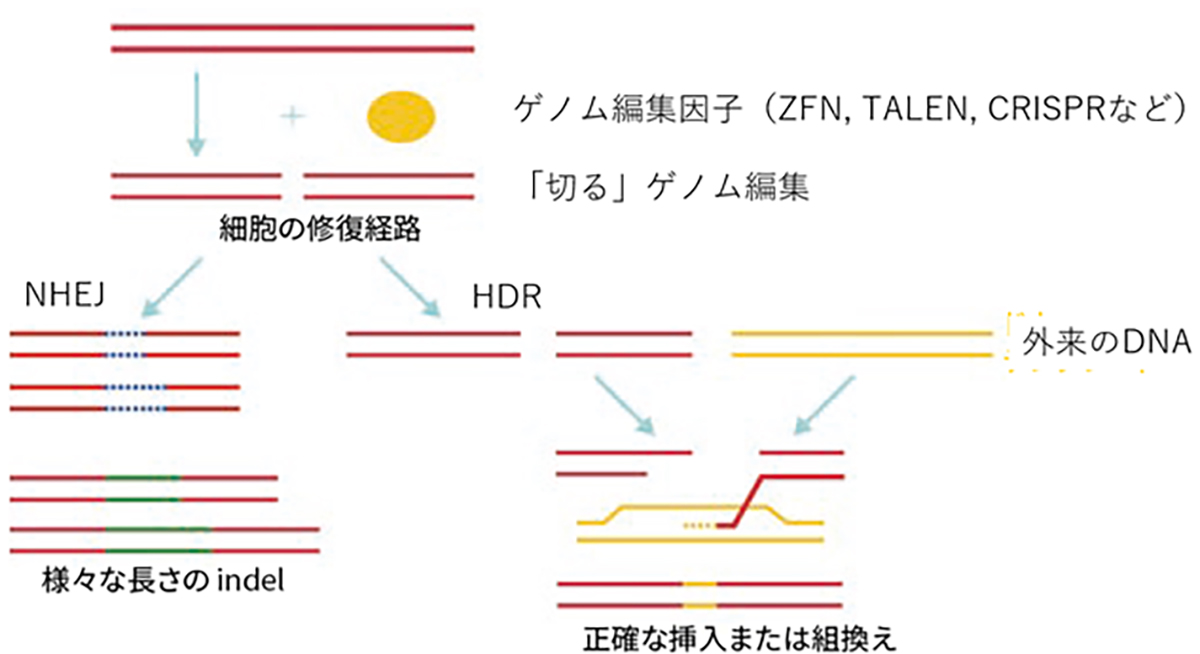
現在頻用されるゲノム編集は狙った配列を「切る」編集で、切断に伴い誘導される細胞内の2つの遺伝子修復機構を利用して、遺伝子を挿入(組み換える)編集や変異を加える編集を行います。遺伝子を挿入する編集は、相同組換え修復(homology-directed repair; HDR)と呼ばれる対立遺伝子から修復遺伝子を合成し組換える修復を利用し、切断時に正常配列を持つ鋳型DNAを外来から供給し組み替える事で正確なゲノム編集が期待できます。変異を加える編集は、非相同末端結合(non-homologous end-joining; NHEJ)と呼ばれる、切断されたDNAの両端を任意の塩基の挿入・欠失(InDel)を伴いながら結合する修復機構を用います。InDelは任意であるため標的遺伝子の改変(主にノックアウト)が起こります。
細胞の遺伝子修復経路依存的なゲノム編集機構
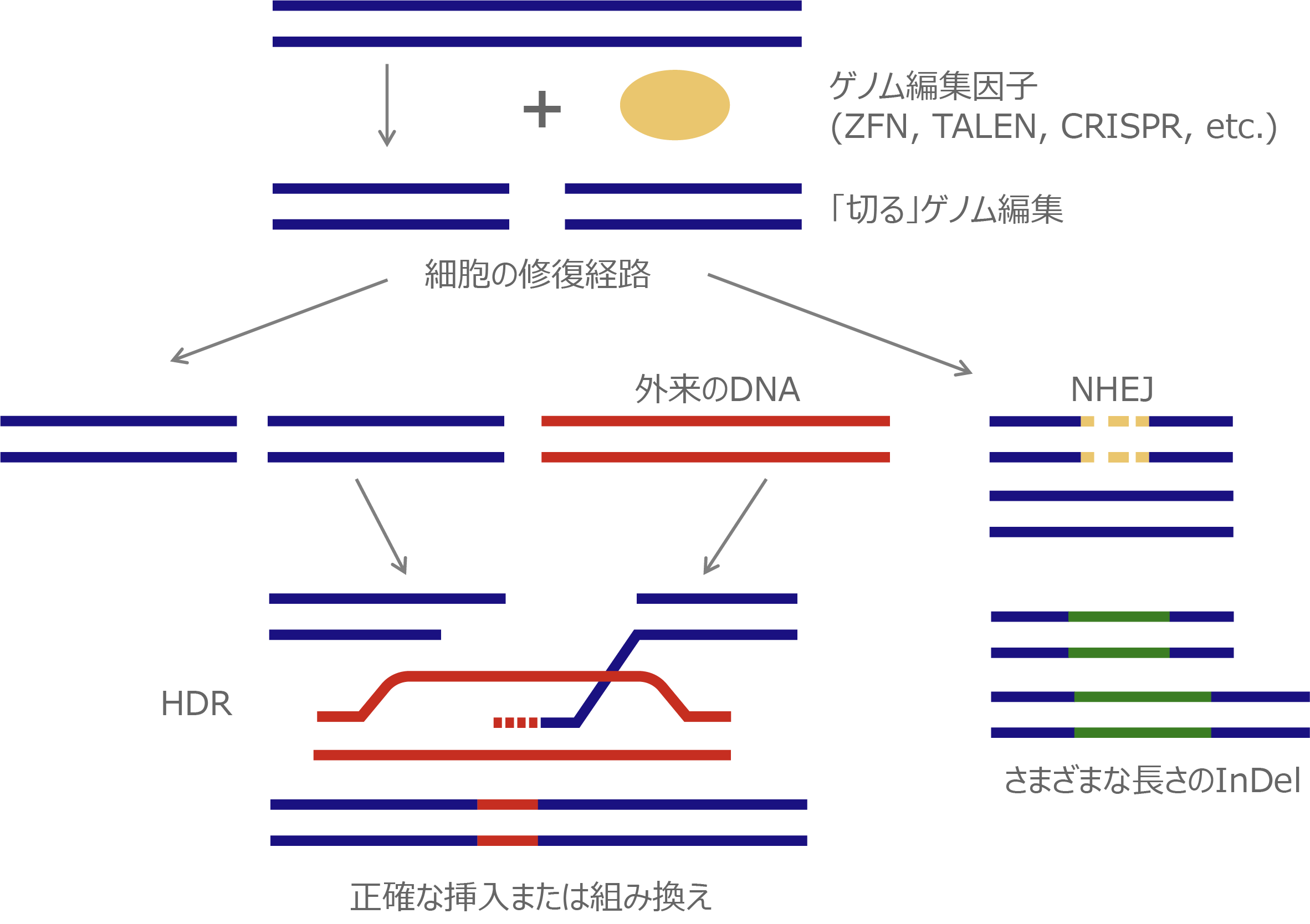
ゲノム編集因子
ゲノム編集を行う酵素はゲノム編集因子と呼ばれ、標的配列をデザインできるゲノム編集因子は第1世代のZFN(Zinc Finger Nuclease)、第2世代のTALEN(Transcription Activator-Like Effector Nuclease)、第3世代のCRISPR(Clustered Regularly Interspaced Short Palindromic Repeats)に大別されます。ZFNは様々な転写因子のDNA結合モチーフが基となっており、1つのモチーフで3塩基対のDNAを認識します。TALENは細菌由来のDNA結合モチーフが基となっており、1つのモチーフで1つのDNAを認識するため、ZFNより配列が長くなりますが特異性の高いゲノム編集因子の設計が可能となりました。CRISPRは細菌の免疫機構(CRISPR/Casシステム)が基になっており、Casヌクレアーゼと標的配列を認識するsgRNA(1本鎖ガイドRNA)で構成されます。タンパク質モチーフで塩基配列を認識するZFN, TALENに比べ、CRISPRは標的配列の認識をRNA-DNA相互作用によって行うため、標的配列の予測や構築が容易になりゲノム編集の研究応用が飛躍的に進みました。
高効率なゲノム編集遺伝子治療
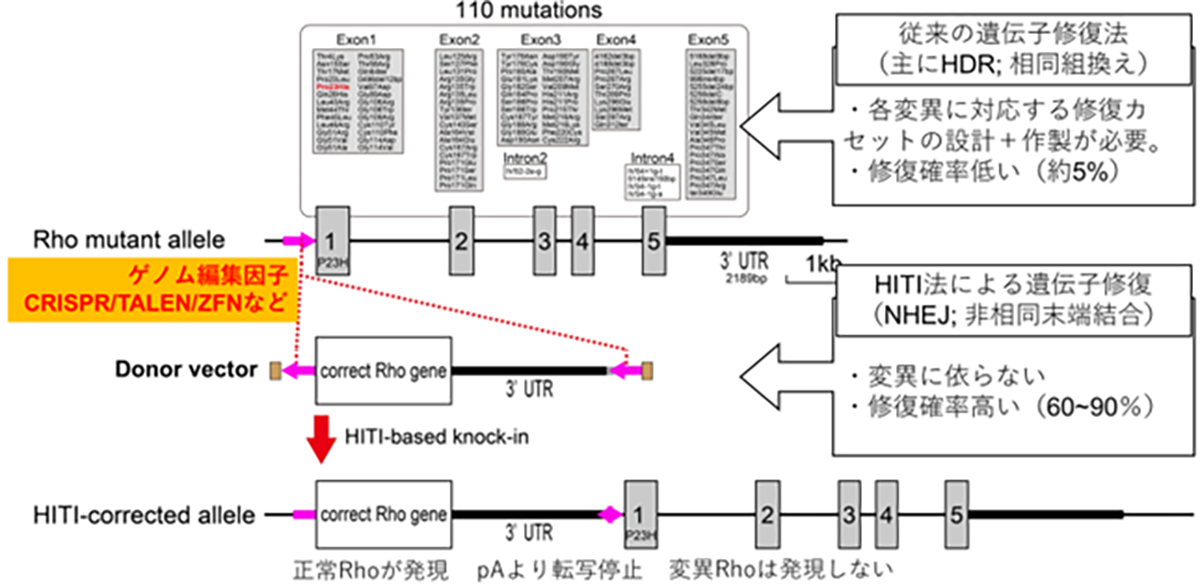
顕性型変異、例えばロドプシンを標的とした原因遺伝子治療製剤には、優性阻害となる原因変異の修復と、正常RHO遺伝子発現の補充の両方への対処が必要となります。ロドプシン遺伝子座には110カ所の変異があるため、各変異に対する遺伝子治療を個別に開発するよりも正常な全長のロドプシン遺伝子を挿入(置換)する方法がより効率的で、1種類の製剤で新規の変異を含む全ての変異を治療する事が可能となります。 正常配列DNAを外から供給する場合はHDRを介したゲノム編集技術が一般的ですが、HDRは分裂細胞での頻度が高く非分裂細胞では低い傾向があります。成体の組織を構成するほとんどの細胞は非分裂細胞であることから、成体細胞に対してのDNAを導入・置換の効率が低い事が課題でした。HITI(Homology-Independent Targeted Integration)法による遺伝子挿入法は、非分裂細胞でも頻度が高いNHEJ修復経路を利用して外来の遺伝子を正しい方向で挿入する技術であり、網膜細胞を含む成体細胞でも高頻度で目的配列に遺伝子を挿入する事が可能となります。変異を持つ遺伝子座の翻訳開始部分(開始コドン)前に正常配列DNA挿入する事で、遺伝子本来のプロモータから挿入した正常遺伝子を発現させつつ、変異遺伝子の発現が停止します。すなわち、顕性型変異における優性阻害となる原因遺伝子の修復と正常RHO遺伝子発現の補充の両方の対処が可能となります。私たちはこのHITI法を応用して、すべてのロドプシン変異を対象とした遺伝子治療薬の開発を進めています。 図:HITI遺伝子導入の図解
HITI法による正常RHO遺伝子を挿入する遺伝子治療法
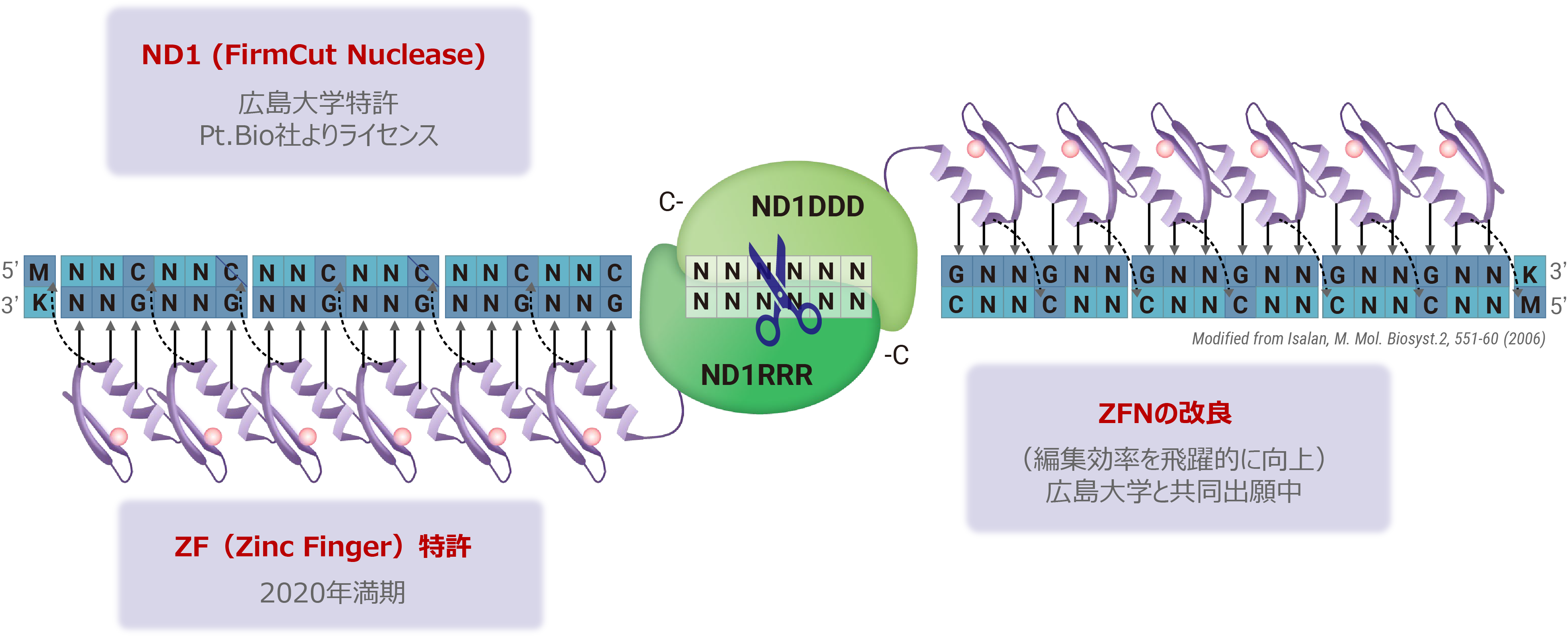
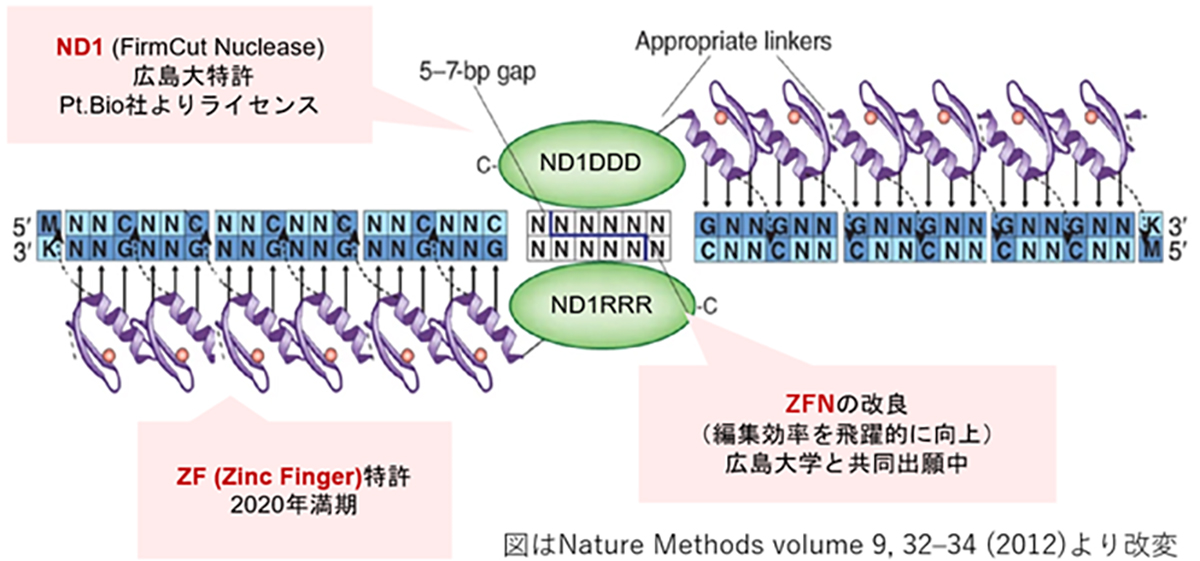
ZFN(Zinc Finger Nuclease)によるゲノム編集技術
ZFNは、CRISPRやTALENよりも分子量が小さくAAV等のベクター(運搬体)に載せやすい利点がある反面、目的配列に特異性の高いZFNの設計が難しく作製に時間を要するため、開発の大きな律速となっていました。私たちは、広島大学との共同研究より特異性の高いZFN開発のハイスループット化を実現し、また同大学が開発したFirmCutヌクレアーゼND1を用いる事等により、成体視細胞でCRISPR-Cas9と同等の切断効率を持つZFNの開発技術を確立しました。 HITI遺伝子挿入による治療製剤の開発には、遺伝子が効率的に機能するためのコンストラクト設計、遺伝子を送達するベクター(運搬体)、そして導入手法の最適化が重要です。私たちの研究では、機能ゲノム学と幹細胞発生学の知見を基にして、遺伝子が効率的に機能するためのコンストラクトを設計しています。また、シンプロジェン社(神戸市)と協力し、高品質のアデノ随伴ウイルスベクターの開発に取り組むとともに、神戸アイセンター病院と連携し適切な導入手法の確立のための研究を進めています。
ZF (Zinc Finger) とFirmCut Nucleaseによる新規ゲノム編集ツール